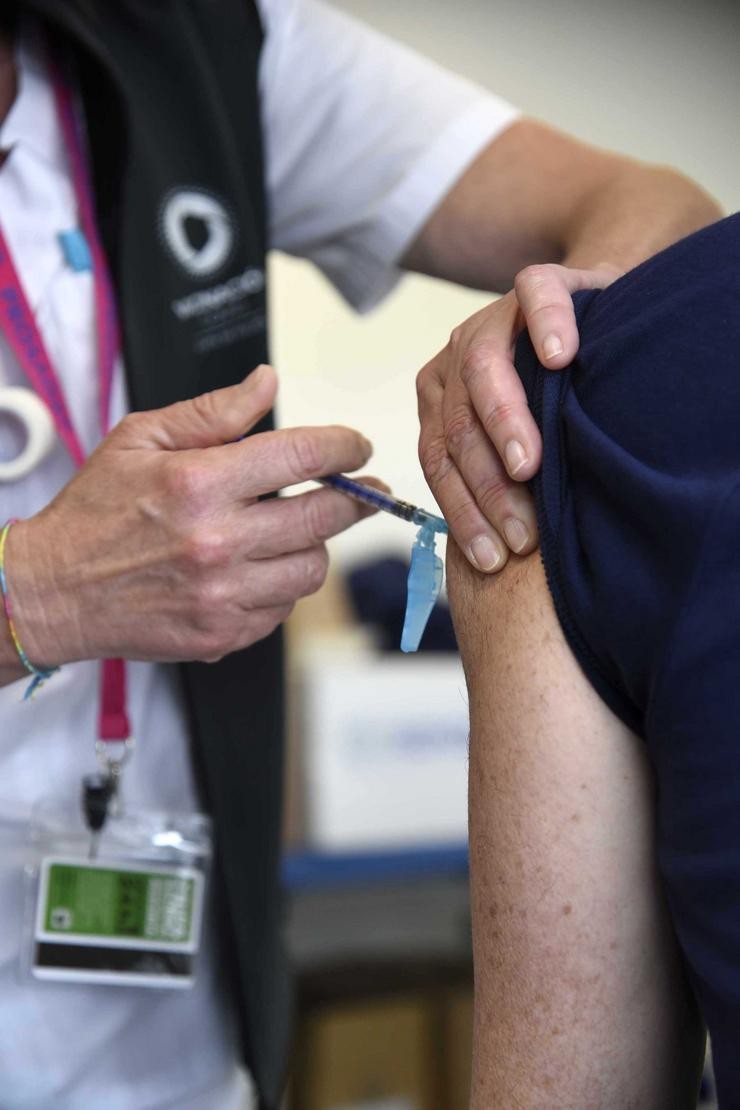
Moderna busca a autorización para a súa vacina contra a COVID en adolescentes de 12 a 17 anos
"Alégranos anunciar que solicitamos a aprobación condicional da comercialización da nosa vacina contra o COVID-19 á Axencia Europea do Medicamento para o seu uso en adolescentes na Unión Europea" din desde a empresa.
Por E.P. | MADRID | 07/06/2021 | Actualizada ás 15:36
Moderna anunciou este luns que presentou á Axencia Europea de Medicamentos (EMA, polas súas siglas en inglés) a solicitude para a aprobación condicional para a comercialización da súa vacina contra o COVID-19 en adolescentes de 12 a 17 anos na Unión Europea.
Segundo sinala nun comunicado, a solicitude está baseada no ensaio de fase 2/3 de mRNA-1273 en adolescentes de entre 12 e 17 anos en Estados Unidos. Nel observouse que a eficacia da vacina nos case 2.500 adolescentes que a recibiron foi do 100% cando se utilizou a mesma definición de casos que no ensaio COVE de fase 3 en adultos.
"Alégranos anunciar que solicitamos a aprobación condicional da comercialización da nosa vacina contra o COVID-19 á Axencia Europea do Medicamento para o seu uso en adolescentes na Unión Europea", dixo Stéphane Bancel, Director Executivo de Moderna.
No estudo observouse unha eficacia da vacina do 93% nos participantes seronegativos a partir dos 14 días posteriores á primeira dose, utilizando a definición de caso secundaria de COVID-19 dos Centros para o Control e a Prevención de Enfermidades (CDC) de EEUU, que analiza un transcurso da enfermidade máis leve.
A vacina de Moderna contra o COVID-19 foi xeralmente ben tolerada, cun perfil de seguridade e tolerabilidad xeralmente consistente co ensaio COVE de fase 3 en adultos. A maioría dos eventos adversos foron de gravidade leve ou moderada. O evento adverso local solicitado máis común foi a dor no lugar da inxección. Os eventos adversos sistémicos solicitados máis comúns despois da segunda dose foron dor de cabeza, fatiga, mialgia e calafríos.
Os datos de seguridade continúan acumulándose e o estudo continúa sendo monitoreado por un comité de monitoreo de seguridade independente. Todos os participantes serán monitoreados durante 12 meses despois da súa segunda inxección para avaliar a protección e seguridade a longo prazo. Estes datos están suxeitos a cambios segundo a recompilación de datos en curso.
A compañía tamén solicitou a autorización en Canadá e presentará unha solicitude de autorización de uso de emerxencia ante a Axencia Norteamericana do Medicamento (FDA, polas súas siglas en inglés).
"Aléntanos o feito de que a vacina de Moderna contra o COVID-19 fose altamente eficaz na prevención da infección por COVID-19 e SARS-CoV-2 en adolescentes. Solicitamos a autorización a Health Canada e solicitaremos unha autorización de uso de emerxencia á FDA estadounidense e ás axencias reguladoras de todo o mundo para esta importante poboación de menor idade. Seguimos comprometidos en axudar a acabar coa pandemia do COVID-19", engadiu Bancel.
Problemas cos comentarios?
Se tes problemas ou suxestións escribe a webmaster@galiciaconfidencial.com indicando: sistema operativo, navegador (e versións).
Agradecemos a túa colaboración.
- Atopan mortas a dúas anciáns na Coruña
- Dous cans foxen dunha leira e atacan a outro can e ao seu dono
- Un falecido tras chocar contra un poste e contra outro vehículo en Viveiro
- Sabes cales son as paisaxes do Camiño de Santiago Francés?
- (Vídeo) Así se lembrou co "Grândola" a Revolución dos Caraveis en Compostela
- CIG denuncia que Educación "borra" o sistema de baixas curtas para non cubrilas e esta nega "disfuncións"















